Analisi dei rischi in ambiente ospedaliero
Annunziata D'Orazio - La Sapienza - Università di Roma
Leo Poggi, Università Campus Bio-Medico di Roma
Le strutture ospedaliere, pubbliche e private, rientrano nell'ambito della normativa relativa ai luoghi di lavoro.
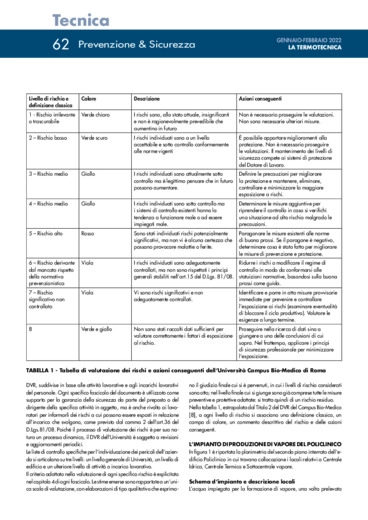
In questo articolo si descrive l'analisi dei rischi condotta sull'impianto di produzione di vapore sterile del Policlinico Universitario Campus Bio-Medico, seguendo il percorso del vapore, dalle prime fasi della sua produzione sino al suo utilizzo come agente sterilizzante in Centrale di Sterilizzazione.
Introduzione
La procedura per la valutazione dei rischi si articola in diverse fasi: l'individuazione dei pericoli presenti in azienda e originati da infrastrutture, attrezzature di lavoro e modalità operative e organizzative; l'analisi dei rischi associati ai pericoli precedentemente individuati; l'individuazione delle misure di prevenzione e protezione adottate che devono abbassare il rischio almeno a un livello accettabile; la stima o ponderazione del rischio residuo; il giudizio finale di valutazione cui si perviene che può essere espresso in varie maniere.
La fase di analisi dei rischi, in cui possiamo senz'altro comprendere l'individuazione dei pericoli, è la parte più propriamente tecnica della valutazione del rischio. La norma tecnica UNI ISO 31000:2018 [2] considera l'analisi dei rischi come un processo di comprensione della natura del rischio e di determinazione del corrispondente livello. Essa fornisce la base per la ponderazione del rischio e per le decisioni orientate alla riduzione ed è relativa anche alla misurazione del rischio.
In questo articolo si descrive l'analisi dei rischi condotta sull'impianto di produzione di vapore sterile del Policlinico Universitario Campus Bio-Medico, seguendo il percorso del vapore, dalle prime fasi della sua produzione sino al suo utilizzo come agente sterilizzante in Centrale di Sterilizzazione. Il presente lavoro si riferisce alle attività di ricognizione degli impianti, di analisi del DVR e di analisi dei rischi, effettuate presso l'area tecnica del Policlinico Universitario Campus Bio-Medico di Roma nei primi cinque mesi del 2020. Le attività di indagine hanno riguardato il funzionamento di ciascuna attrezzatura e il ruolo di ciascun operatore coinvolto nel processo di produzione, distribuzione e utilizzo del vapore sterile. L'analisi del percorso del vapore è articolata nelle due fasi successive, una riguardante esclusivamente l'impianto di produzione del vapore e una rivolta all'utilizzo del vapore in Centrale di Sterilizzazione. I pericoli inerenti la prima fase di produzione sono essenzialmente legati alla presenza di vapore a elevate pressione e temperatura all'interno delle attrezzature. Le norme di riferimento sono contenute nel D.Lgs. 81/08 [1], per ciò che concerne la tutela della sicurezza degli operatori presenti nei locali tecnici, e nella Direttiva 2014/68/UE del Parlamento Europeo e del Consiglio (PED) [3] sulle attrezzature a pressione, per quanto riguarda i controlli e le verifiche alle quali sottoporre l'impianto ai fini di una mitigazione del rischio.
Successivamente, ci si è concentrati sulla valutazione del rischio vapore nelle sterilizzatrici. Per la fase di utilizzo all'interno della Centrale di Sterilizzazione, i pericoli sono anche legati alle condizioni del vapore nelle sterilizzatrici (pressione, temperatura e titolo del vapore saturo) da cui sostanzialmente dipende l'efficacia nell'eliminazione dei microrganismi dai dispositivi medici durante la fase di sterilizzazione (rischio clinico). Si è pertanto fatto ampio riferimento al Regolamento 2017/745/UE [4] sui dispositivi medici, così come al Testo Unico e alla Direttiva PED, in relazione alla tutela degli operatori addetti alla sterilizzazione e al controllo delle sterilizzatrici in quanto macchine a pressione.
La fase di analisi dei rischi, in cui possiamo senz'altro comprendere l'individuazione dei pericoli, è la parte più propriamente tecnica della valutazione del rischio. La norma tecnica UNI ISO 31000:2018 [2] considera l'analisi dei rischi come un processo di comprensione della natura del rischio e di determinazione del corrispondente livello. Essa fornisce la base per la ponderazione del rischio e per le decisioni orientate alla riduzione ed è relativa anche alla misurazione del rischio.
In questo articolo si descrive l'analisi dei rischi condotta sull'impianto di produzione di vapore sterile del Policlinico Universitario Campus Bio-Medico, seguendo il percorso del vapore, dalle prime fasi della sua produzione sino al suo utilizzo come agente sterilizzante in Centrale di Sterilizzazione. Il presente lavoro si riferisce alle attività di ricognizione degli impianti, di analisi del DVR e di analisi dei rischi, effettuate presso l'area tecnica del Policlinico Universitario Campus Bio-Medico di Roma nei primi cinque mesi del 2020. Le attività di indagine hanno riguardato il funzionamento di ciascuna attrezzatura e il ruolo di ciascun operatore coinvolto nel processo di produzione, distribuzione e utilizzo del vapore sterile. L'analisi del percorso del vapore è articolata nelle due fasi successive, una riguardante esclusivamente l'impianto di produzione del vapore e una rivolta all'utilizzo del vapore in Centrale di Sterilizzazione. I pericoli inerenti la prima fase di produzione sono essenzialmente legati alla presenza di vapore a elevate pressione e temperatura all'interno delle attrezzature. Le norme di riferimento sono contenute nel D.Lgs. 81/08 [1], per ciò che concerne la tutela della sicurezza degli operatori presenti nei locali tecnici, e nella Direttiva 2014/68/UE del Parlamento Europeo e del Consiglio (PED) [3] sulle attrezzature a pressione, per quanto riguarda i controlli e le verifiche alle quali sottoporre l'impianto ai fini di una mitigazione del rischio.
Successivamente, ci si è concentrati sulla valutazione del rischio vapore nelle sterilizzatrici. Per la fase di utilizzo all'interno della Centrale di Sterilizzazione, i pericoli sono anche legati alle condizioni del vapore nelle sterilizzatrici (pressione, temperatura e titolo del vapore saturo) da cui sostanzialmente dipende l'efficacia nell'eliminazione dei microrganismi dai dispositivi medici durante la fase di sterilizzazione (rischio clinico). Si è pertanto fatto ampio riferimento al Regolamento 2017/745/UE [4] sui dispositivi medici, così come al Testo Unico e alla Direttiva PED, in relazione alla tutela degli operatori addetti alla sterilizzazione e al controllo delle sterilizzatrici in quanto macchine a pressione.
Settori: Sicurezza industriale
Parole chiave: Sicurezza sul lavoro
- RS Italia
- Pagano Saverio
- RFID GLOBAL by Softwork
- RFID GLOBAL by Softwork
- CTI - Comitato Termotecnico Italiano Energia e Ambiente
- Leuze Electronic
 English
English